1. ORIGEM DO SAL NO OCEANO A quantidade total de água no mundo foi estimada em 1.500.000.000 km3.1 Desse total, cerca de 97%, ou 1.455.000.000 km3, corresponde aos oceanos. Os oceanos contêm sais dissolvidos em concentrações médias de 35 kg por m3 de água do mar. Assim, em peso, a quantidade total de sal nos oceanos é de cerca de 50 × 1015 toneladas, uma quantidade enorme em qualquer medida.2 Os cientistas não têm certeza da origem de todo esse sal, mas geralmente é aceito que a maioria deve ter se originado como constituinte das rochas terrestres (isto é, na litosfera), degradada no tempo geológico e transportada para os oceanos pela vazão de córregos e rios.3 De todos os íons de sal dissolvidos nos oceanos, o sódio (Na+) e o cloreto (Cl-) são responsáveis por cerca de cinco das seis partes (5/6) (em peso). Na forma elementar, tanto o metal de sódio (Na) quanto o gás cloro (Cl) são altamente reativos; no entanto, quando combinado no composto cloreto de sódio, este último se mostra altamente estável. A principal aplicação industrial do cloreto de sódio é para o transporte e a comercialização de seus constituintes. Grandes quantidades de cloreto de sódio são extraídas da água do oceano e dos lagos de sal para serem usadas como matéria-prima na produção de gás cloro (Cl) e hidróxido de sódio (soda cáustica) (NaOH).
2. A NATUREZA DO SAL
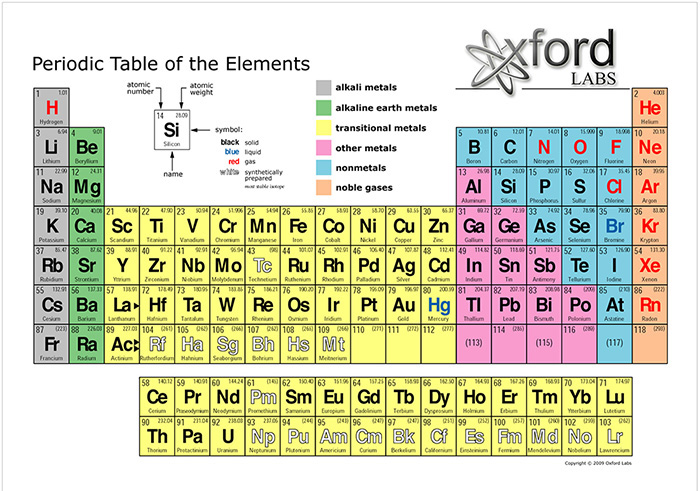
Os sais são compostos químicos que se originam na reação de um ácido e uma base. Eles são compostos de cátions (íons carregados positivamente) e ânions (íons carregados negativamente), de modo que essa combinação é eletricamente neutra. Os íons de sal podem ser inorgânicos ou orgânicos. Os cátions de sais inorgânicos mais comuns são o sódio (Na+), magnésio (Mg+), potássio (K+) e cálcio (Ca+). Esses íons estão agrupados por número atômico na Tabela Periódica dos Elementos Químicos. Seus números atômicos são 11, 12, 19 e 20, respectivamente, próximo ao canto superior esquerdo da Fig. 2.
O ânion de sal inorgânico mais comum é o cloreto (Cl-), com número atômico 17; o outro ânion de sal inorgânico é o fluoreto (F-), com número atômico 9 (Fig. 2). Sódio e cloreto são de longe os íons de sal mais abundantes na (parte oceânica da) hidrosfera.4 No seu estado mineral, o cloreto de sódio é conhecido como halita; na forma comum é chamado de sal de cozinha (Fig. 3).
3. A ORIGEM DO SAL A natureza é composta de quatro esferas: (1) biosfera, (2) litosfera, (3) hidrosfera e (4) atmosfera. Eles interagem entre si para formar a ecosfera, a soma total da Natureza, abrangendo todos os seres vivos e não-vivos. A litosfera contém os quatro cátions de sais inorgânicos mais comuns (Na+, Ca+, Mg+ e K+) em quantidades consideráveis; no entanto, contém apenas quantidades muito pequenas de ânions elementares de sal (Cloreto Cl- e Fluoreto F-).4 Assim, para formar compostos de sal, os ânions devem ser fornecidos por [pelo menos uma das] outras esferas. O cloreto é amplamente fornecido pela hidrosfera.4 O cloreto também é fornecido em pequenas quantidades (aerossóis) pelos oceanos para a atmosfera, eventualmente retornando à hidrosfera através da precipitação. A Tabela 1 mostra a presença relativa dos quatro cátions de sal mais comuns na litosfera. Os dois maiores componentes iônicos da litosfera são oxigênio (O-) e silício (Si+), em 60,4 e 20,5% dos átomos, respectivamente. Os cátions de sais inorgânicos (Na+, Ca+, Mg+ e K+) constituem 2,49, 1,88, 1,77 e 1,37% dos átomos, respectivamente, da litosfera (Tabela 1, Coluna 3).4 A coluna 7 da Tabela 1 mostra que os cátions de sais inorgânicos constituem cerca de 11,1%, em peso, da litosfera. Isso significa que, para cada tonelada (1.000 kg) de rochas litosféricas desagregadas por intemperismo, erosão e outros processos naturais, cerca de 111 kg de cátions de sal são liberados para as outras esferas. A coluna 7 mostra que os quatro cátions salinos inorgânicos estão presentes uniformemente na litosfera.
Qual fração dessa quantidade (111 kg por tonelada) é incorporada nas três outras esferas? O sódio está ausente na biosfera e na atmosfera, mas está presente significativamente na hidrosfera. Cálcio, magnésio e potássio estão presentes na biosfera e na hidrosfera, mas ausentes na atmosfera. [Observe que o nitrogênio, um constituinte importante da biosfera, está amplamente ausente da litosfera, sendo sua fonte principal a atmosfera].4 Após ser liberado pela litosfera, o sódio é arrastado apenas pela hidrosfera, enquanto o cálcio, o magnésio e o potássio são absorvidos pela biosfera e pela hidrosfera. Aparentemente, o sódio não é ingerido pela biosfera em quantidade considerável, comparado com os outros cátions salinos.4 Essas observações estão resumidas na Tabela 2.
Existem amplas evidências que sugerem que quantidades significativas de potássio e magnésio são absorvidas pela biosfera terrestre, enquanto a maior parte do cálcio e sódio é liberada pela biosfera, apenas para se juntar à hidrosfera continental. Os íons de potássio são essenciais para o funcionamento de todas as células vivas. Um átomo de magnésio está no centro de cada molécula de clorofila.4 A hidrosfera é seletiva no uso de cátions de sal. A Tabela 3 compara as porcentagens do teor de sal iônico na água do oceano e na água do rio.2 É possível observar que na água do oceano os íons salinos predominantes são cloreto (Cl-) e sódio (Na+). Por outro lado, na água do rio os íons salinos predominantes são o bicarbonato (HCO3-), cálcio (Ca+), sílica (SiO2-) e sulfato (SO4-). Cloreto (Cl-) e sódio (Na+) são os próximos da lista, também com porcentagens significativas. Existem várias razões para essa seletividade. Bicarbonato e sulfato aparecem na água do rio como os principais produtos da biodegradação. O cálcio e o sódio aparecem na água do rio, porque não são usados significativamente pela biosfera, que descarta o excesso de cálcio e sódio, lixiviando-os na água do rio. O potássio e o magnésio também aparecem na água do rio, mas em porcentagens menores que o cálcio e o sódio.
As Tabelas 4a a 4c mostram a porcentagem dos quatro cátions salinos mais comuns em: (a) litosfera, (b) água do rio e (c) água do oceano, respectivamente. Observa-se que a presença de potássio e magnésio na litosfera é muito maior que a presença na água do rio. O cálcio parece ser pouco afetado pela biosfera, e o mesmo se aplica ao sódio. Como resultado do sequestro biosférico de potássio e magnésio, a quantidade de cátions de sais inorgânicos realmente despejados na água do rio é muito menor do que a de origem litosférica. Um valor de 50% pode ser considerado uma estimativa aproximada da porcentagem de cátions salinos litosféricos entregues à água do rio. Isso significaria que cerca de 55 kg de cátions salinos são entregues na água do rio para cada tonelada de rocha intemperizada e erodida, uma quantidade considerável em qualquer medida. Em comparação, a queima de uma tonelada de matéria orgânica produz apenas cerca de 12 kg de minerais das cinzas.4 Isso ressalta a natureza química diferente da hidrosfera (água do rio) e da biosfera.
Enquanto o cálcio e o sódio são descartados pela biosfera terrestre, justificando sua presença na água do rio, a ausência de cálcio dissolvido na água do oceano (Tabela 4c) requer justificativa adicional. A contradição é resolvida quando se percebe que a biosfera oceânica é realmente um reservatório de cálcio, utilizado por uma variedade de organismos marinhos para a construção de conchas e esqueletos.2 A Tabela 5 resume as descobertas da Tabela 4. O único cátion salino inorgânico que permanece em solução nos oceanos é o sódio. Não existe um processo biológico conhecido para remover os íons de sódio dos oceanos.2 Juntamente com o cloreto, um constituinte da hidrosfera, esses dois íons representam 85,7% de todos os sólidos dissolvidos na água do oceano (a soma das duas primeiras linhas da Coluna 3, Tabela 3). A solubilidade extremamente alta do cloreto de sódio na água, a mais alta de qualquer substância conhecida, garante que, uma vez dissolvido na água do rio, o cloreto de sódio permanece em solução quando atinge seu ponto final nos oceanos e por todo o tempo.
4. O DIREITO DA NATUREZA Com a origem dos íons salinos estabelecida e seu destino esclarecido, conclui-se que a natureza (neste caso, a biosfera terrestre) reservou para si o direito de descartar seus resíduos de sal. Os cátions de cálcio e sódio são amplamente desperdiçados pela biosfera terrestre, uma vez que, como qualquer outro resíduo, são fornecidos em quantidades que excedem em muito a demanda real. Depois de chegar ao oceano, o cálcio é usado pelos organismos marinhos, deixando o sódio - e o cloreto, seu parceiro onipresente - como os únicos resíduos verdadeiros da natureza. Nas drenagens continentais periféricas, com vazões exorreicas (de saída), córregos e rios servem ao propósito de liberar os sais excedentes para o oceano. Esse direito fundamental da natureza é exercido desde o início dos tempos.3 As bacias de drenagem exorreica, normalmente localizadas na periferia dos continentes, são efetivamente capazes de liberar seus sais no oceano. Por outro lado, as drenagens endorreicas, geralmente localizadas no interior dos continentes, são incapazes de liberar seus sais e, ao invés disso, acumulam-nos no tempo geológico. O fato de uma dada bacia ser exorreica ou endorreica dependerá da localização continental e da geomorfologia local/regional.5 O que é certo é que as bacias totalmente exorreicas estão efetivamente em equilíbrio salino, sem acúmulo líquido de sais, enquanto as drenagens endorreicas não. Em geral, o endorreísmo acumula sais, desencorajando o desenvolvimento de diversos ecossistemas e, assim, prejudicando a vida. Por outro lado, as drenagens exorreicas liberam os sais excedentes, permitindo que eles continuem a sustentar a vida normal em sua miríade de formas. Quanto maior a massa continental, maior a chance de endorreísmo (Fig. 4). No entanto, as drenagens exorreicas têm uma clara vantagem sobre as endorreicas em relação ao balanço de sal.
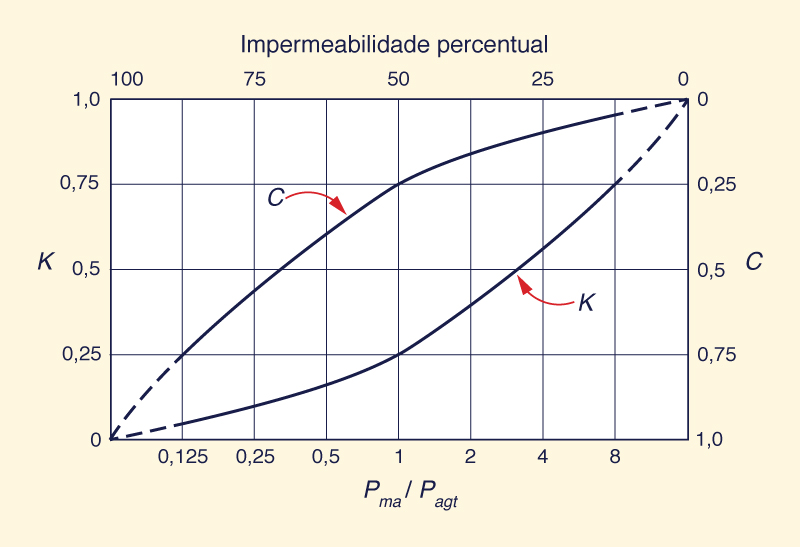
Em resumo, para bacias continentais periféricas, os rios servem ao propósito de levar os sais indesejados para o oceano, onde devem permanecer fora de vista e da mente. Nesse contexto, os rios são vistos como exportadores naturais de sal para o oceano.3 A redução da vazão do rio pela retirada antrópica (e sua eventual conversão em evaporação por irrigação) tem o efeito de mudar gradualmente uma drenagem exorreica para uma endorreica, comprometendo o balanço natural de sal. No entanto, é exatamente isso que os humanos vêm fazendo nos últimos tempos, principalmente durante o século passado. 5. O DESIGN DA NATUREZA O ciclo hidrológico é o motor primordial da natureza. Consiste em três caminhos: (1) precipitação, (2) evaporação e (3) escoamento. Depois de atingir a superfície do solo, a precipitação se separa em escoamento e evaporação. Por meio do escoamento, a água é devolvida diretamente ao oceano, de onde se originou; por meio da evaporação, a água é devolvida à atmosfera, cortando o ciclo hidrológico. Numa base anual global, cerca de um terço da precipitação aparece como escoamento, enquanto a fração restante (cerca de dois terços) é convertida em vapor de água e devolvida à atmosfera. Anualmente, a razão entre escoamento e precipitação é denominada coeficiente de escoamento superficial K. Este coeficiente varia muito, baixo como K = 0,02 até alto como K = 0,93 em casos extremamente incomuns.7 O coeficiente de escoamento superficial K não deve ser confundido com o coeficiente de escoamento eventual C que é usado em hidrologia urbana. Enquanto K é uma função do clima, C é uma função do grau de impermeabilidade da bacia hidrográfica em questão. A Figura 5 mostra um modelo conceitual aproximado de coeficientes de escoamento, em que K é uma função de Pma/Pagt, ou seja, a razão entre a precipitação média anual (Pma) e a precipitação terrestre global anual (Pagt). O último é aproximadamente Pagt = 800 mm.8
A natureza projetou o ciclo hidrológico para que a evaporação e o escoamento fossem compartilhados na precipitação. Em um extremo, para K = 0, o escoamento é zero e a evaporação é máxima; neste caso não há meios naturais para remover os sais da bacia de drenagem. Assim, os sais se acumulam sem limite, prejudicando substancialmente os processos vitais e limitando a diversidade do ecossistema. É o caso das bacias endorreicas, normalmente localizadas no interior dos continentes, principalmente onde o escoamento superficial não foi capaz de encontrar uma saída para o oceano mais próximo. O resultado final é um deserto de sal, onde a vida é limitada, não apenas devido à falta de água, mas também ao acúmulo interminável de sal. [Um exemplo extremo de endorreismo antropogênico é o do mar Salton, na Califórnia, onde um lago de sal foi formado nos últimos 80 anos pela drenagem agrícola em uma depressão que ocorre naturalmente, o Salton Sink. Os sais continuam acumulando-se no mar de Salton, sem fim aparente].9 No outro extremo, para K = 1, a evaporação é zero e o escoamento é máximo. Sob esse esquema, o sistema é claramente incapaz de sustentar qualquer vegetação. A vegetação requer um suprimento constante de umidade para que as plantas vasculares mantenham o turgor e, assim, evitem o murchamento. O resultado final também é um deserto, pois não há possibilidade de estabelecimento da vegetação. Os casos anteriores são extremos irrealistas, apresentados aqui apenas para fins de discussão. Atualmente, a natureza divide a água disponibilizada pela precipitação em duas frações distintas: uma para evaporação e outra para o escoamento. Os valores reais dependem significativamente do clima, e também da geologia local e regional, geomorfologia e localização continental.
Onde o escoamento é superior à média, a vegetação tende a cobrir toda a superfície do solo; assim, a evaporação segue por dois caminhos: (1) através da vegetação (evapotranspiração) e (2) pelos corpos d'água (Fig. 6). Nesse caso, um intervalo típico é de cerca de
Por outro lado, onde o escoamento é menor que a média, a vegetação não cobre toda a superfície do solo; assim, a evaporação segue por três caminhos: (1) através da vegetação (evapotranspiração), (2) pelos corpos d'água e (3) pelo solo exposto (Fig. 8). Nesse caso, o intervalo típico é de cerca de
Seguindo o design da natureza, os valores centrais de K são mais propícios à saúde do ecossistema e à diversidade ecológica. Para K ≅ 0 , o sistema está estressado devido à falta de escoamento e excesso de sais. Para K ≅ 1, o sistema está estressado devido ao excesso de escoamento e à falta de vegetação. Em teoria, a partição ideal da precipitação deve corresponder a K = 0,3, isto é, aproximadamente um terço vai para o escoamento e os dois terços restantes para a evaporação. Na prática, essa situação pode corresponder aproximadamente ao meio do espectro climático, que separa os climas semiárido (no lado seco) e subúmido (no lado úmido).8
A discussão anterior havia proposto que um coeficiente de escoamento muito baixo (K ≅ 0) são muitos, a exceção em paisagens naturalmente exorreicas. Uma bacia com coeficiente de escoamento muito baixo geralmente leva ao acúmulo de sal, uma vez que o escasso escoamento é insuficiente para transportar todos os sais. Bacias com assentamentos humanos significativos geralmente apresentam coeficientes de escoamento superficial na faixa de 6. O DESIGN DO HOMEM Em tempos recentes, mais precisamente nos últimos cem anos, os seres humanos tenderam a estabelecer terras semiáridas e áridas, onde a água disponível pode ser insuficiente para satisfazer todas as necessidades, inclusive naturais e antropogênicas. As necessidades naturais são as do ecossistema predominante, que requer água para o seu funcionamento normal. As necessidades antropogênicas são aquelas impostas pelo assentamento humano, comprovadamente para alimentos e fibras, mas também para usos domésticos e industriais. Por exemplo, o limite entre regiões semiáridas e áridas é de 400 mm de precipitação média anual.8 Isso deve corresponder (em uma bacia totalmente exorreica) a um coeficiente de escoamento superficial K em torno de 0,2. Frequentemente, essa quantidade de água é insuficiente para satisfazer todas as necessidades encontradas. Um uso antropogênico da água é o consumo na irrigação, para produzir alimentos e fibras adicionais para satisfazer a demanda crescente. Os ecossistemas naturais são os primeiros da fila a absorver sua parcela de água por evaporação e evapotranspiração; portanto, esse valor já está comprometido. Para os seres humanos, a única saída foi a conversão do escoamento em evapotranspiração por meio de irrigação. Isso produz mais alimentos e fibras, mas o custo é a redução do coeficiente de escoamento superficial (o consumo de água na irrigação precisa vir de algum lugar!). Efetivamente, os alimentos e fibras adicionais obtidos diminuíram a capacidade da bacia de liberar seus sais.
Há quem argumente que a água do escoamento é preciosa demais para desperdiçá-la nos oceanos. Sob essa ótica equivocada, toda gota de água que entra no escoamento deve ser armazenada e destinada a usos econômicos. A irrigação é particularmente preocupante porque, se desenvolvida sem limites, leva ao eventual desaparecimento de todo o escoamento. Com isso, quando todo o escoamento é convertido em evaporação, o coeficiente de escoamento reduz a zero, preparando o terreno para ser tomado por um deserto infestado de sal
A solução é limitar, através de regulamentação apropriada, a conversão antrópica do escoamento em evapotranspiração. Observa-se que nas regiões semiáridas e áridas, onde a irrigação é mais necessária, a produção de alimentos e fibras resulta em menos escoamento quando, na realidade, é necessário mais escoamento para realizar com êxito a remoção dos sais extras. Uma lição a ser retirada do registro histórico é a da pouco conhecida civilização Hohokam, que prosperou no centro do Arizona por mais de 1.200 anos, até seu desaparecimento inexplicável por volta de 1.450 d.C. (Fig. 10).10 Inundações, secas e acúmulo de sal foram usadas na tentativa de racionalizar o desaparecimento dos Hohokam, que, de maneira apropriado, no idioma local Pima significa "aqueles que desapareceram".11 A salinidade pode se destacar como a culpada mais provável, já que as inundações realmente enriquecem o solo com nutrientes frescos e as secas geralmente são temporárias. Além disso, a salinidade é difundida e difícil de gerenciar, particularmente em um ambiente árido como o da região central do Arizona.
Nas últimas duas décadas, a sustentabilidade da irrigação foi examinada minuciosamente, principalmente pelo Manual of Practice No. 71 da ASCE.12 De um lado, há quem defenda o retorno da agricultura em terras secas, o que implica o abandono da irrigação como um empreendimento humano desejável. O problema começou com o assentamento de terras áridas, que os humanos podem ter perseguido seriamente em busca de mais terra, saúde e sol. Exceto a destruição do assentamento em terras áridas, que neste momento parece politicamente irrealista na melhor das hipóteses, o único caminho viável a seguir é a regulamentação da irrigação. Há sentido prático em reservar uma parte do escoamento com o objetivo claro de liberar os sais da bacia.13 Esse parece ser o único caminho sustentável a seguir. 7. NO BALANÇO SALINO DA BACIA O conceito de equilíbrio salino da bacia ajuda a explicar o conflito entre o design da natureza e o dos seres humanos. A natureza pretendia que as bacias totalmente exorreicas estivessem em equilíbrio salino, ou seja, sem acúmulo líquido de sal ao longo do tempo. Por outro lado, as bacias endorreicas não estão em equilíbrio salino, passando por um processo contínuo de acumulação de sal ao longo do tempo geológico. É importante observar que o padrão de drenagem real nem sempre pode estar claro. Em alguns casos, atendendo à geomorfologia local, as bacias podem ser semiendorreicas ou semiexorreicas, dependendo de qual processo, coleta de sal ou descarga de sal, é mais prevalente e até que ponto. Por exemplo, a bacia do Alto Paraguai, localizada perto do centro geográfico da América do Sul, é, para todos os efeitos, uma bacia exorreica, com vazão média anual de 1.565 m3/s em sua foz, a confluência com o rio Apa, no Mato Grosso do Sul, Brasil.14 No entanto, a presença demonstrada de salinas, ou lagoas salinas, em alguns lugares, mostra que nem todas as áreas da bacia estão conectadas ao sistema de drenagem principal (Figs. 11 e 12).15 De fato, a bacia do Alto Paraguai, embora pareça estar em equilíbrio regional de sal, pode na verdade não estar em equilíbrio local de sal. Assim, em grandes bacias subúmidas de caráter delta continental como o Alto Paraguai, a geomorfologia local desempenha um papel crucial no condicionamento do endorreísmo.
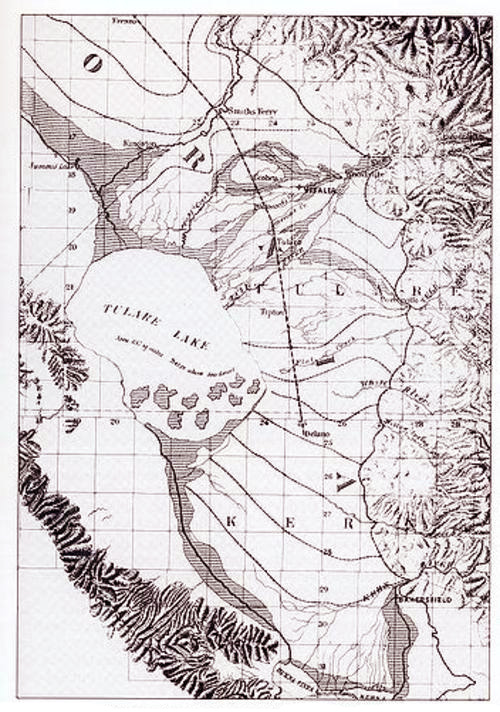
A escolha entre exorreísmo e endorreísmo é clara. Como os sais geralmente acabam degradando os ecossistemas naturais, particularmente nas regiões áridas/semiáridas, as bacias exorreicas devem ser preferidas às endorreicas. Preservar ou conservar o equilíbrio salino de uma bacia - presumivelmente o mais próximo possível da realidade - é o objetivo primordial do gerenciamento sustentável da bacia. O exemplo da Inland Empire Brine Line, na bacia hidrográfica do rio Santa Ana, na Califórnia, mostra que o objetivo é alcançável.16 Nesse caso, a localização continental periférica da bacia favoreceu claramente o objetivo do balanço salino. 8. O CASO DA BACIA DO LAGO TULARE Um exemplo histórico, embora extremo, de sequestro antrópico de escoamento (e sal) é o da Bacia do Lago Tulare, localizada perto da ponta sul do Central Valley da Califórnia. Na década de 1840, no início dos assentamentos contemporâneos da região, o lago Tulare era o maior lago de água doce a oeste do rio Mississippi e o segundo maior dos EUA, com base na área de superfície. Na elevação de 66 m, seu nível mais alto de transbordamento, registrado em 1862 e 1868, o Lago Tulare media 790 milhas quadradas (Fig. 13).17
Durante a maior parte do século XIX, o lago Tulare funcionou como uma bacia semiendorreica, coletando seu próprio escoamento local e regional dos rios South Fork Kings, Kaweah, Tule e Kern. Durante períodos de inundação pouco frequentes, à altitude acima de 63 m, o lago Tulare transbordava para o norte, pelo rio Fresno Slough, na bacia do rio San Joaquin, lavando uma parte de seus sais. Durante o período de 29 anos entre 1850 e 1878, o lago Tulare transbordou 19 vezes. A vazão total durante esse período foi estimada em 1.055.000 acre-pés.17 Nenhum transbordamento ocorreu após 1878 devido ao aumento de desvios das vazões dos tributários para irrigação e do uso municipal da água. Em 1899, o lago secou, exceto por zonas úmidas residuais e inundações ocasionais. O desenvolvimento da irrigação na Bacia do Lago Tulare significou efetivamente que, nos últimos 140 anos, todo o escoamento foi retido dentro dos limites do lago e, com ele, todos os sais. Além dos sais já presentes em quantidades normais no escoamento natural, a irrigação de terras áridas efetivamente cria novos sais residuais (de cálcio e sódio) desagregando os solos geologicamente jovens para extrair os sais úteis (magnésio e potássio).18 Assim, o desenvolvimento da irrigação representa um golpe duplo: menos escoamento disponível para transportar os sais regionais e mais sal produzido localmente.
Na Bacia do Lago Tulare, os sais estão sendo armazenados nas bacias de evaporação (Fig. 14). Para lidar com a quantidade crescente de sal, um hábitat artificial de aves aquáticas foi implementado nos últimos anos (Fig. 15). O efeito desse processo massivo de acúmulo de sal no ambiente circundante, acima e abaixo do solo, ainda precisa ser elucidado.
Pillsbury (1981), por um lado, apresentou uma perspectiva sombria das consequências do acúmulo de sal nas bacias de evaporação.3 Ele afirma, a saber:
As compensações do extensivo desenvolvimento da irrigação, particularmente de terras áridas, são obviamente claras. Mais alimentos e fibras serão produzidos, mas ao custo de sais adicionais, o que exigirá descarte apropriado. A falta de gerenciamento adequado de sal tornará o sistema de irrigação insustentável a longo prazo. Como Pillsbury apontou habilmente, é uma questão de tempo até que o sistema comece a mostrar suas falhas. O caso da bacia do Lago Tulare pode ser um exemplo extremo de sequestro de sal antropogênico, mas não é de forma alguma um caso isolado. Todo o desenvolvimento da irrigação, particularmente nas terras áridas, acabará aumentando: (a) a salinidade das vazões a jusante, ou (b) a salinidade das águas subterrâneas locais.3 Assim, as compensações do desenvolvimento da irrigação devem ser examinadas criticamente. Em muitos casos, quando todos os fatores são cuidadosamente considerados, a viabilidade do desenvolvimento da irrigação pode ser ilusória.12 9. CONCLUSÕES As seguintes conclusões são derivadas deste estudo:
Em resumo, os íons de sódio e cálcio são produzidos pela desintegração litosférica em quantidades muito superiores às que poderiam ser assimiladas pela biosfera terrestre. Nas drenagens exorreicas, os resíduos resultantes foram (e estão sendo) transportados para o oceano por córregos e rios. Nas drenagens endorreicas, é acumulado no interior dos continentes, produzindo bacias salinas fechadas. Em geral, o exorreísmo é preferível ao endorreísmo, pois leva a ecossistemas mais saudáveis e diversificados. O desenvolvimento da irrigação converte o escoamento em evaporação, reduzindo a quantidade de água disponível para a descarga de sal. Ao mesmo tempo, particularmente nas regiões áridas e semiáridas, onde é mais necessária, a irrigação mobiliza novos sais por meio da biodegradação adicional de solos geologicamente jovens.18 No limite, quando todo o escoamento é sequestrado e convertido em evaporação, nenhum escoamento é deixado para transportar os sais para o oceano. Como o sistema é gradualmente direcionado para esse limite, torna-se insustentável, não por falta de água para sustentar a vegetação, mas por falta de água para lavar os sais. Atendendo à ciência hidrológica, postulamos que a Natureza tinha um plano diferente: em média, dois terços da água disponível para o ecossistema e o terço restante para a lavagem de todos os sais, regionais e locais (novos sais).3 A estratégia de reter quase todo ou todo o escoamento superficial, com base no equívoco da água ser "preciosa", só poderia levar à eventual conversão de bacias continentais periféricas em bacias artificiais infestadas de sal. Parece mais certo que esse não foi o design da Natureza. REFERÊNCIAS 1 Penman, H. L. 1970. The water cycle. Scientific American, Vol. 223, No. 3, September, 99-108. 2 Swenson, H. 2015. Why is the ocean salty? U.S. Geological Survey publication. 3 Pillsbury, A. F. 1981. The salinity of rivers. Scientific American, Vol. 245, No. 1, July, 54-65. 4 Deevey, E. S. 1970. Mineral cycles. Scientific American, Vol. 223, No. 3, September, 149-158. 5 Ponce, V. M. 2014. Ecohydroclimatological research: The case for geomorphology. Online article. 6 Railsback, L. B. 2006. Some fundamentals of mineralogy and geochemistry. Online article, Consulted on February 19, 2015. 7 L'vovich, M. I. 1979. World water resources and their future. Translation from Russian by Raymond L. Nace, American Geophysical Union. 8 Ponce, V. M., R. P. Pandey, and S. Ercan. 2000. Characterization of drought across climatic spectrum. Journal of Hydrologic Engineering, ASCE, Vol. 5, No. 2, April, 222-224. 9 Ponce, V. M. 2005. The Salton Sea: An assessment. Online article. 10 Encyclopædia Britannica. Hohokam culture. Consulted on February 19, 2015. 11 Arizona Museum of Natural History. The Hohokam. Consulted on February 19, 2015. 12 American Society of Civil Engineers. 1990. Irrigated agriculture: Is it sustainable? Chapter 28 in Agricultural salinity assessement and management. Manuals and Reports on Engineering Practice No. 71, 1st edition, New York. 13 Ponce, V. M. 2009. Sustainable runoff for basin salt balance. Online article. 14 Ponce, V. M. 1995. Hydrologic and environmental impact of the Parana-Paraguay Waterway on the Pantanal of Mato Grosso, Brazil: A reference study. San Diego State University, San Diego, California. 15 Martins, E. R. C. 2012. Tipologias de lagoas salinas no Pantanal de Nhecolândia (MS). Doctoral dissertation, Universidade de São Paulo, São Paulo, Brazil. 16 Santa Ana Watershed Project Authority. 2012. Inland Empire Brine Line. Consulted on February 15, 2015. 17 ECORP Consulting, Inc. 2007. Tulare Lake basin hydrology and hydrography: A summary of the movement of water and aquatic species. U.S. Environmental Protection Agency. 18 Rhoades, J. D., D. B. Krueger, and M. J. Reed, 1968. The effect of soil-mineral weathering on the sodium hazard of irrigation waters. Soil Science Society of America Proceedings, Vol. 32, 643-647. PDF file: download Adobe Acrobat Reader | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 190917 13:30 |